医疗器械在医疗保健领域发挥着至关重要的作用,它提供诊断、预防、治疗、监测和康复功能。在印度尼西亚,医疗器械受卫生部 (MoH) 监管,以确保其安全性、有效性和质量。监管框架根据风险将医疗器械分为不同的类别,并规定了监管流程、注册要求和监督。本文将深入探讨这些分类、每种分类的标准以及印度尼西亚的相关注册流程。
印度尼西亚医疗器械分类
医疗器械 在印度尼西亚,医疗器械分类对于根据相关风险定义各类医疗器械的监管框架至关重要。该体系与包括全球医疗器械协调工作组 (GHTF) 和东盟医疗器械指令 (AMDD) 在内的国际指南保持一致,以确保全球协调一致,同时兼顾本地需求。I、II 和 III 类医疗器械的分类不仅是一种分类,更是影响整个监管流程的基础,包括注册的复杂性、适用的审查程序以及相关成本。每种分类都规定了具体的监管要求,确保根据医疗器械的风险状况对其安全性和有效性进行适当的评估。
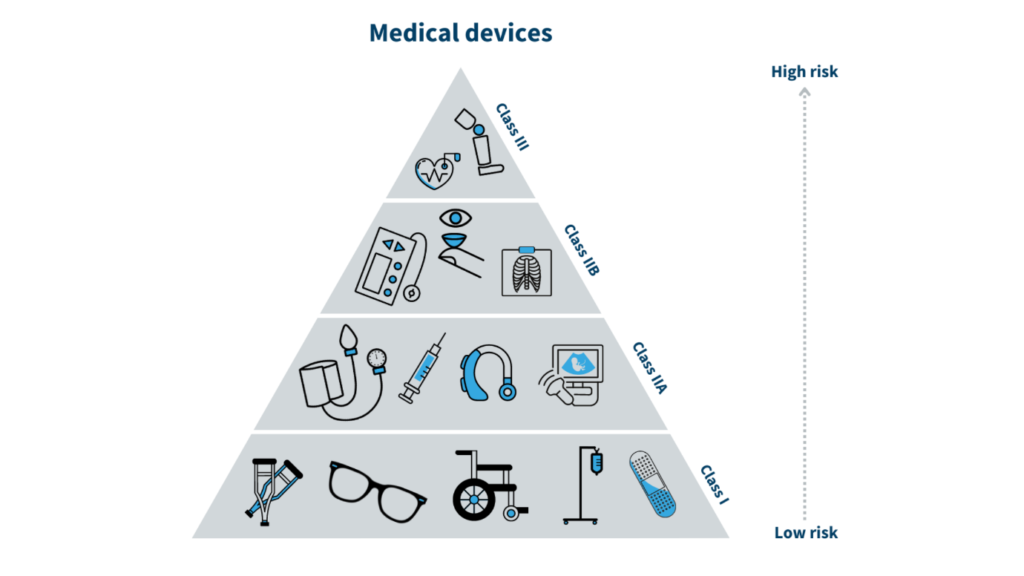
I 类(低风险设备)
I类器械是三种分类中最简单的,这意味着对用户的风险极小。这些器械通常不需要无菌条件或特殊监测即可确保安全有效。I类器械的常见示例包括简易绷带、非测量型听诊器、拐杖和手术手套。该分类的标准侧重于这些器械的低风险特性。它们是非侵入性的,这意味着它们不会进入人体或穿透皮肤,并且不需要直接测量即可正常运作。I类器械的监管要求相对简单。注册流程简化,通常约需15天,且仅需极少的文档,包括器械标签、制造商信息和基本风险分析。I类器械的注册相关费用也较低,约为1,500,000印尼盾(US$115)。
II 类(中等风险设备)
至于 II 类器械,它们被认为比 I 类器械具有更高的风险,因此需要更严格的监管。这些器械包括输液泵、心电图机、X 光机和麻醉机。II 类器械的标准反映了它们具有中等健康风险,因为它们具有侵入性或可能与用户直接接触,因此需要仔细监测,有时甚至需要消毒。II 类器械的监管要求包括更全面的注册流程,通常需要 30 天左右。该流程涉及详细评估,包括临床评估报告、风险管理文件和良好生产规范 (GMP) 证书。相关费用较高,约为 3,000,000 印尼盾 (US$230),反映了这些器械受到的更严格的审查和监管要求。
III 类(高风险设备)
III 类器械代表最高风险类别,专门用于那些一旦发生故障可能导致严重伤害甚至死亡的器械。这些器械包括植入式器械,例如起搏器、除颤器和假肢。III 类器械的标准侧重于其高风险性质,因为它们通常可植入或提供治疗决策所需的关键测量数据。这些器械的监管要求最为严格,注册流程最长可达 45 天。此类器械需要提供全面的文件,包括临床试验、生物相容性研究和临床评估报告。III 类器械的注册费也最高,约为 5,000,000 印尼盾 (US$340),这反映了这些器械对患者安全至关重要。严格的要求确保只有安全性和有效性得到验证的器械才能获准在印度尼西亚使用。
印度尼西亚医疗器械注册流程
印度尼西亚的医疗器械注册流程包含多个步骤,旨在确保这些器械在合法上市前的安全性、有效性和质量。该流程根据器械的分类(I类、II类或III类)而有所不同,并且每种分类都有各自的要求。对于希望进入印度尼西亚市场的制造商来说,了解这些步骤至关重要,因为它们决定了所需文件以及每种器械类别相关的时间和成本。
上市前注册
该流程首先通过有执照的当地进口商或经销商向卫生部 (MoH) 提交申请表。此表必须包含有关该器械的全面信息,例如其预期用途、设计规格和临床评估。申请人必须提供一份执行摘要,概述该器械的用途和优点以及详细的标签信息,包括使用说明、禁忌症、警告和注意事项。此外,提交材料还需要制造商的详细信息,包括 ISO 13485 认证(医疗器械质量管理标准),证明符合国际最佳制造实践。风险分析对于评估与器械使用相关的潜在风险至关重要。还需要一份基于临床试验和研究的临床评估报告,以显示安全性和有效性。此外,还需要制造商所在国家/地区的自由销售证书 (FSC),证明该器械可以在该国自由销售,以证明该器械在国际市场上的接受度。必须提供生物相容性测试文件,证明该器械的材料对人体使用是安全的。注册费用因器械分类而异; I类器械费用较低,约为1,500,000印尼盾(US$115)。II类和III类器械由于复杂性和文档要求较高,费用较高。
上市后注册
卫生部评估所有提交的文件并进行风险评估后,将颁发产品许可证和注册号。许可证持有人必须是当地实体,可以是进口商或分销商,并且必须维持注册状态。产品许可证的有效期通常为2至5年,具体取决于器械类型和授权书(LOA)。必须在许可证到期前续期,才能继续在印度尼西亚合法销售该器械。上市后阶段对于保持符合监管标准至关重要,尤其是在器械的包装、标签或技术规格发生变化时。细微变更可以提交修订申请,而重大变更则可能需要重新注册。当地实体有责任确保所有更新和修订都及时通知卫生部,从而确保器械在市场整个生命周期内都符合法规。注册后的监管监督旨在确保器械的持续安全性和有效性,使卫生部能够监测不良事件并根据需要对产品规格进行必要的更新。
印度尼西亚电子目录注册
印度尼西亚政府推出电子目录系统标志着 医疗器械 已注册并采购的医疗器械。该在线平台允许列出已注册的医疗器械,并供医疗机构和政府采购实体访问,从而简化采购流程。将医疗器械纳入电子目录需要进行全面评估,以确保其符合卫生部 (MoH) 制定的特定标准和监管要求。获得产品许可证后,医疗器械可通过持有执照的本地进口商上传至电子目录。此流程需要提交必要的文件,例如执行摘要、详细标签信息、风险分析和临床评估报告。为确保安全性和有效性,医疗器械必须符合当地质量管理标准,包括 ISO 13485 认证。

将设备列入电子目录的好处是多方面的。通过将采购流程整合到单一数字平台,可以减轻制造商和医疗保健提供商的行政负担。这加快了采购流程,并通过增强供应商竞争力降低了采购成本。此外,电子目录系统还提高了透明度,使人们能够更轻松地根据设备的技术规格、价格和安全记录进行比较。对于制造商而言,列入电子目录可以显著提高市场准入和知名度,尤其是对于外国实体而言。它提供了一个集中平台,使政府机构能够快速识别和采购必要的设备,从而改善印度尼西亚的整体医疗保健服务。
印尼医疗器械注册的挑战与思考
尽管电子目录系统有诸多优势,但也给制造商带来了诸多挑战。主要障碍之一是要求外国制造商通过持有执照的当地进口商提交注册申请。这种中介角色可能会增加流程的成本和复杂性。当地代表的参与确保了符合当地法规。这有利于与卫生部的沟通,但如果进口商对监管要求缺乏了解或相关方之间协调不足,也可能导致延误。与卫生部的沟通是另一个关键挑战。监管流程可能涉及多次互动,需要提供补充信息或更正。如果提交的文件不完整或提供的数据存在歧义,这可能会成为瓶颈。沟通过程的反复性可能会延迟注册时间,影响医疗器械在市场上的供应。此外,印度尼西亚的监管框架是动态的,不断更新,例如引入了医疗器械清真认证要求。制造商必须保持警惕,并随时了解监管环境的任何变化,以确保其产品始终合规。要及时了解这些更新,需要积极与卫生部合作,并主动管理监管组合,这可能会耗费大量资源,特别是对于不熟悉当地监管环境的外国公司而言。
结论
总结一下, 医疗器械 印度尼西亚的医疗器械注册遵循与全球标准(特别是全球协调工作组 (GHTF) 指南)相一致且与东盟医疗器械指令 (AMDD) 相协调的结构化框架。I、II 和 III 类分类决定了器械对患者和用户构成的风险级别,从而影响注册流程、监管审查和相关成本。每个类别都有不同的标准和监管要求,从 I 类器械的最低限度文档到 III 类器械的全面评估,包括临床试验和生物相容性测试。电子目录的推出进一步简化了采购流程,提高了透明度和效率。要完成这些分类和注册流程,需要透彻了解监管环境和电子目录系统的具体要求,这对于想要在印度尼西亚市场取得成功的制造商至关重要。






