- 在 Regalkes 上创建帐户:首先在 雷加尔克斯 平台。这需要提供业务详情和授权代表的联系信息。对于外国制造商,必须指定持有必要许可证的当地经销商。 医疗器械经销商许可证(MDDL).
- 准备并上传文件:账户设置后,通过 雷加尔克斯 平台。文件应完整准确,以避免处理延误。任何缺失或翻译错误的文件都可能导致申请被拒或审核时间延长。
- 支付注册费:提交后,卫生部将生成申请费发票。 A类 设备通常售价约为 1,500,000 印尼盾 (125美元), B类和C类 设备成本约为 3,000,000印尼盾 (225 美元),以及 D类 设备售价为 5,000,000印尼盾 (350 美元)。付款必须在 7个日历日 收到发票。
- 审查与评估:卫生部将对所提交的文件进行评估,审查时间根据器械类别而有所不同:
- A类:45天
- B类:90天
- C类:100天
- D类:120天
如果需要补充信息,教育部将通知申请人并要求其提供必要的文件。申请人必须 10-15个工作日 提交重新评估所需的文件。
5. 发行 Nomor Izin Edar (NIE):卫生部批准注册后,将颁发 诺莫尔·伊津·埃达尔(NIE)这是在印度尼西亚合法销售该设备所需的监管许可证。该许可证的有效期最长为 5年,之后需要进行更新过程。
- D类:120天
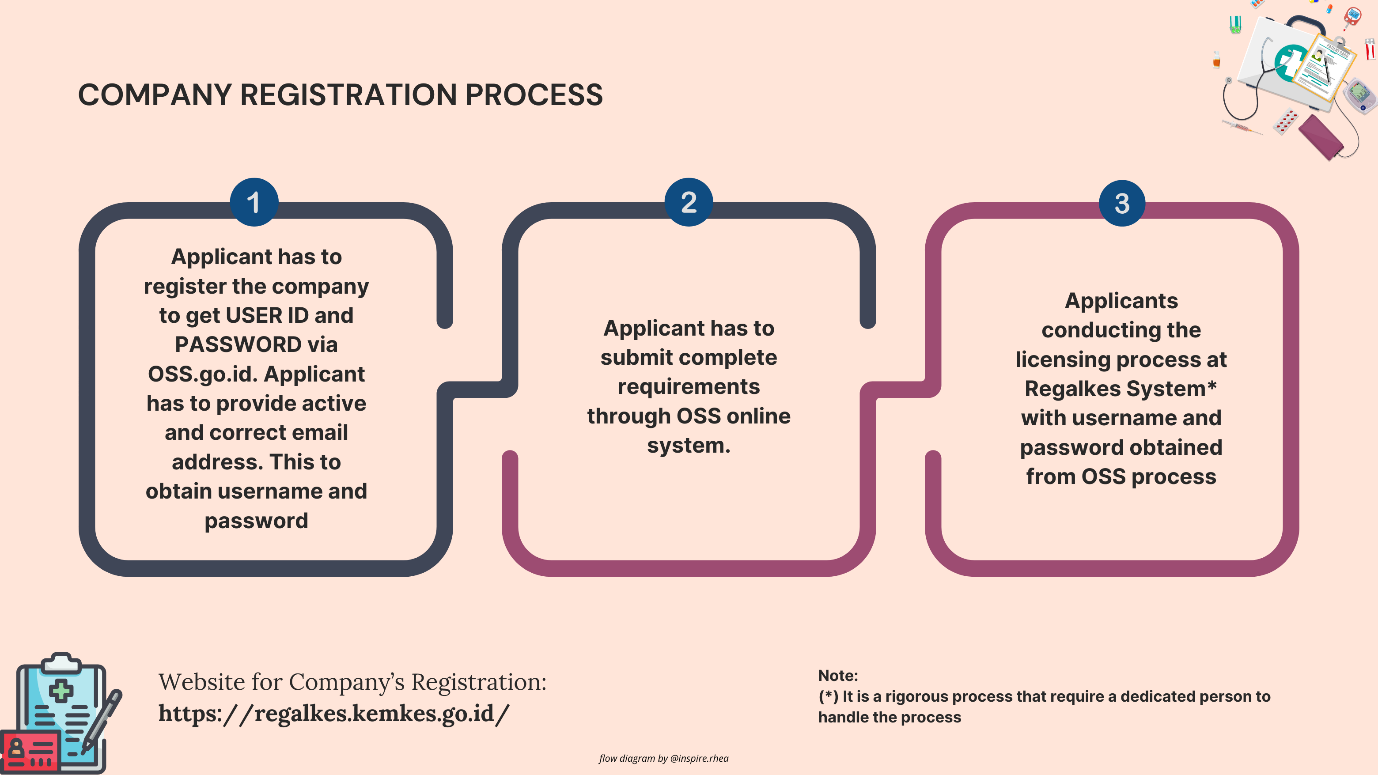
- 图3:医疗器械注册前的一般步骤
4. 印度尼西亚医疗器械认证:成本和时间
时间表 印度尼西亚医疗器械认证 可能会因设备类别而异。通常,注册过程对于 A类 设备和速度较慢 C类 和 D类 由于测试和文档要求更加严格,因此设备。
以下是成本和时间表的简要摘要:
- A类: 成本 125美元,处理时间 1-2个月.
- B类和C类: 成本 225美元,处理时间 3-4个月.
- D类: 成本 350美元,处理时间 4-6个月.
此外,设备更新通常需要 1,000,000印尼盾 (75 美元),并且必须每天完成 5年.

5. 电子目录注册:竞争优势
对于旨在向公立医院和医疗机构供应医疗器械的企业, 印度尼西亚电子目录注册 是至关重要的一步。 电子目录 是印度尼西亚政府用于从注册制造商采购医疗产品的在线采购系统。
要在电子目录中注册,企业必须满足特定条件 良好分销规范(GDP) 要求并提供全面的文件,包括医疗器械的 诺莫尔·伊津·埃达尔(NIE)。在电子目录中列出有几个好处:
- 政府访问:公立医院和医疗机构使用电子目录采购医疗器械,为制造商提供与这些机构的直接联系。
- 市场知名度:在电子目录中登记的设备将优先获得政府采购,从而可以大幅增加销售量。
- 降低加价:当设备列在电子目录中时,区域经销商就没有利润空间,从而提高了定价和竞争力。
6. 医疗器械注册流程中的挑战
虽然 印度尼西亚医疗器械注册 流程很简单,但企业可能会面临一些常见的挑战:
- 语言障碍:所有文件必须翻译成 印尼语,并且无法提供准确的翻译可能会导致延误。
- 本地测试: 为了 C类和D类 有些设备可能需要在当地认可的实验室进行测试,这会增加批准所需的成本和时间。
- 分销商和许可证转让问题:一旦选定分销商,更换分销商可能会很困难。许可证通常不可转让,可能需要重新申请,从而导致严重的延误。
- 复杂文档:对于高风险设备,例如 D类,公司必须提交更全面的临床数据,这使得文档处理过程变得复杂且耗时。
结论
成功导航 印度尼西亚医疗器械注册 对于希望进入市场的企业来说,流程至关重要。通过了解医疗器械分类系统、准备正确的文件并遵循必要的步骤, 雷加尔克斯 平台,企业可以顺利进入市场。此外,在 电子目录 可以进一步提高进入公共机构的机会,为印度尼西亚的医疗保健领域提供竞争优势。
通过充分的准备和对监管要求的清晰理解,企业可以自信地进入印度尼西亚市场,并在这个快速发展的医疗保健领域将其医疗产品带给消费者。







