- Regalkesでアカウントを作成する: まずアカウントを作成してください レガルケス プラットフォーム。これには、事業内容の詳細と正式な代表者の連絡先情報の提供が必要です。外国メーカーの場合、必要な資格を有する現地販売代理店を任命することが必須です。 医療機器販売業者ライセンス(MDDL).
- ドキュメントの準備とアップロード: アカウント設定後、必要な書類をすべて提出してください。 レガルケス プラットフォーム。処理の遅延を避けるため、書類は完全かつ正確である必要があります。書類の不足や誤訳は、却下または審査期間の延長につながる可能性があります。
- 登録料を支払う: 提出後、保健省は申請料金の請求書を発行します。 クラスA デバイスの価格は一般的に 1,500,000ルピア (125米ドル) クラスBとC デバイスの価格は 3,000,000ルピア (225米ドル)、および クラスD デバイスの価格は 5,000,000ルピア (350米ドル)。お支払いは 7暦日 請求書を受け取ること。
- レビューと評価: 保健省は提出された書類を評価し、審査期間は機器のクラスによって異なります。
- クラスA: 45日間
- クラスB: 90日間
- クラスC: 100日
- クラスD: 120日
追加情報が必要な場合、省は申請者に通知し、必要な書類の提出を求めます。申請者は 10~15営業日 再評価のために必要な書類を提出します。
5. ノモール・イジン・エダル(NIE)の発行保健省が登録を承認すると、 ノモール・イジン・エダール(NIE)インドネシアでこの機器を合法的に販売するために必要な規制ライセンス。ライセンスの有効期間は最長 5年その後は更新手続きが必要となります。
- クラスD: 120日
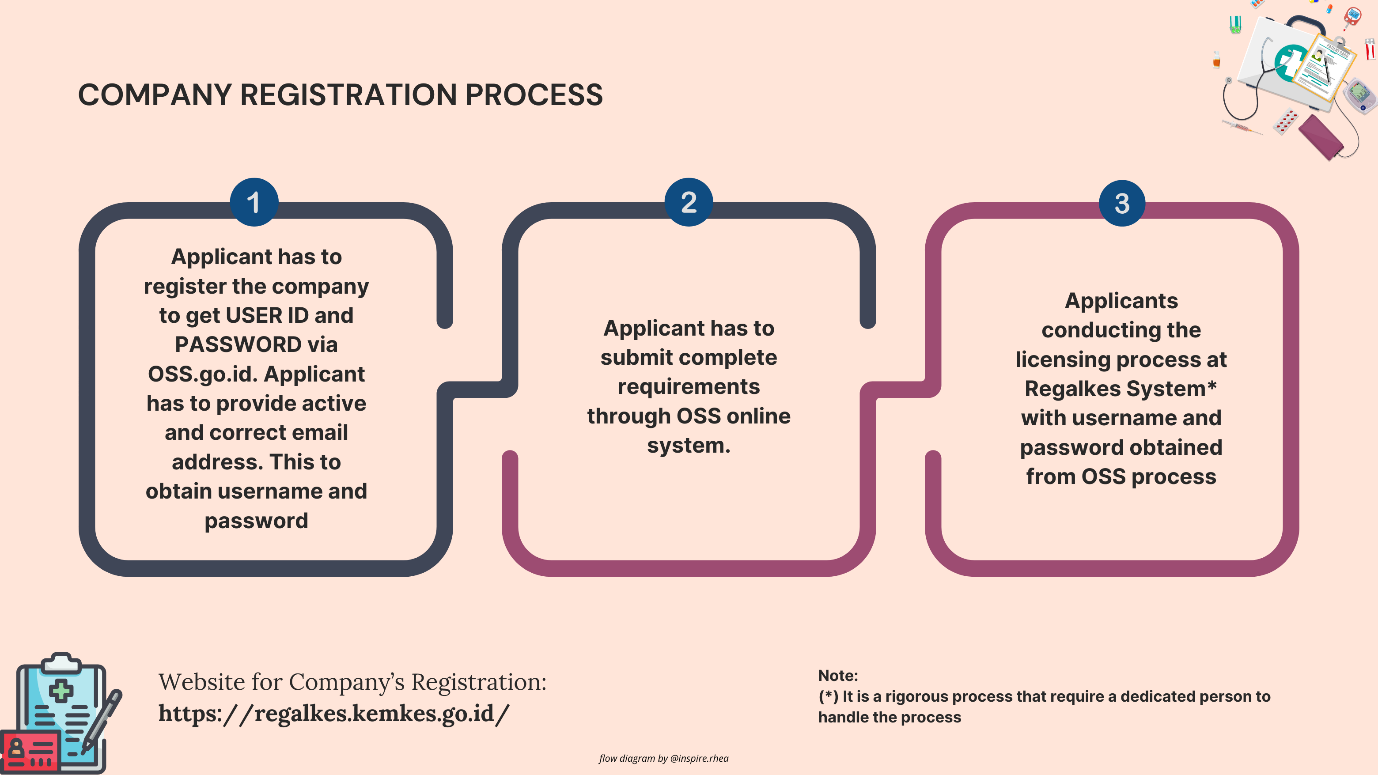
- 図3:医療機器登録前の一般的な手順
4. インドネシアの医療機器認証:費用とスケジュール
タイムライン インドネシアの医療機器認証 デバイスのクラスによって異なる場合があります。通常、登録プロセスは クラスA デバイスと速度が遅い クラスC そして クラスD より厳格なテストと文書化の要件により、デバイスが制限されるようになりました。
コストとタイムラインの簡単な概要は次のとおりです。
- クラスA: 料金 125米ドル、処理時間 1~2ヶ月.
- クラスBとC: 料金 225米ドル、処理時間 3~4ヶ月.
- クラスD: 料金 350米ドル、処理時間 4~6ヶ月.
さらに、デバイスの更新には通常、 1,000,000ルピア (USD 75)で、 5年.

5. 電子カタログ登録:競争上の優位性
公立病院や医療機関への医療機器供給を目指す事業者様へ 電子カタログ登録インドネシア は重要なステップです。 電子カタログ インドネシア政府が登録メーカーから医療製品を購入するために使用するオンライン調達システムです。
電子カタログに登録するには、企業は特定の条件を満たす必要があります。 適正流通基準(GDP) 医療機器の要件を含む包括的な文書を提供し、 ノモール・イジン・エダール(NIE)電子カタログに掲載すると、次のようないくつかの利点があります。
- 政府アクセス公立病院や医療施設は電子カタログを使用して医療機器を調達し、メーカーにこれらの機関への直接リンクを提供します。
- 市場の可視性: 電子カタログに登録された機器は政府調達に優先的に採用されるため、販売量を大幅に増やすことができます。
- マークアップの削減デバイスが電子カタログに掲載されると、地域のディーラーのマージンの余地がなくなり、価格設定と競争が向上します。
6. 医療機器登録プロセスにおける課題
一方、 インドネシアの医療機器登録 プロセスは簡単ですが、企業が直面する可能性のある一般的な課題がいくつかあります。
- 言語の壁: すべての文書は インドネシア語正確な翻訳が提供されない場合、遅延が発生する可能性があります。
- ローカルテスト: のために クラスCとD 一部のデバイスでは、現地の認定研究所でのテストが必要になる場合があり、承認に必要なコストと時間がさらに増加します。
- 販売代理店およびライセンス譲渡に関する問題: 一度販売代理店を選定すると、別の販売代理店への切り替えは困難を極める可能性があります。ライセンスは通常譲渡不可であり、再申請が必要となる場合があり、大幅な遅延が生じる可能性があります。
- 複雑なドキュメント: リスクの高いデバイスの場合、 クラスD企業はより包括的な臨床データを提出する必要があり、文書化プロセスが複雑になり、時間がかかります。
結論
うまくナビゲートして インドネシアの医療機器登録 市場参入を目指す企業にとって、このプロセスは重要です。機器分類システムを理解し、適切な文書を準備し、必要な手順を踏むことで、 レガルケス プラットフォームを利用することで、企業はスムーズな市場参入を実現できます。さらに、 電子カタログ 公的機関へのアクセスをさらに強化し、インドネシアの医療分野で競争上の優位性をもたらします。
徹底した準備と規制要件の明確な理解があれば、企業は自信を持ってインドネシア市場に参入し、急速に成長するヘルスケア業界において自社の医療製品を消費者に届けることができます。






